Упражнения и итоги "Уравнение состояния идеального газа. Газовые законы"
Упражнения
- Газ сжат изотермически от объема V1 = 8 л до объема V2 = 6 л. Давление при этом возросло на Δp = 4 кПа. Каким было начальное давление p1?
- Компрессор, обеспечивающий работу отбойных молотков, засасывает из атмосферы V = 100 л воздука в секунду. Сколько отбойных молотков может работать от этого компрессора, если для каждого молотка необходимо v = 100 см3 воздуха в секунду при давлении p = 5 МПа? Атмосферное давление p = 100 кПа.
- Построить изотермы для 2 г водорода при 0°C в координатах p, V; V, T и p, T.
- Определить температуру газа, находящегося в закрытом сосуде, если давление газа увеличивается на 0,4% первоначального давления при нагревании на 1 К.
- При переходе определенной массы газа из одного состояния в другое его давление уменьшается, а температура увеличивается. Как меняется его объем?
- Чему равен объем одного моля идеального газа при нормальных условиях?
- Найти массу воздуха в классе, где вы занимаетесь, при температуре 20°C и нормальном атмосферном давлении. Молярную массу воздуха принять равной 0,029 кг/моль.
- Плотность некоторого газообразного вещества 2,5 кг/м3 при температуре 10°C и нормальном атмосферном давлении. Найти молярную массу этого вещества.
- В баллоне объемом 0,03 м3 находится газ под давлением 1,35 * 106 Па при температуре 455°C. Какой объем занимал бы этот газ при нормальных условиях (t0 = 0°C, p0 = 101325 Па)?
- Высота пика Ленина на Памире равна 7134 м. Атмосферное давление на этой высоте 3,8 * 104 Па. Определить плотность воздуха на вершине пика при 0°C, если плотность воздуха при нормальных условиях 1,29 кг/м3.
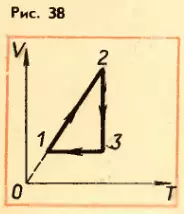
- На рисунке 38 дан график изменения состояния идеального газа а координатам V, T. Представить этот процесс на графиках в координатах p, V и p, T.
- Выразить среднюю квадратическую скорость молекулы через универсальную газовую постоянную и молярную массу.
- В баллоне находится газ при температуре 15°C. Во сколько раз уменьшится давление газа, если 40% его выйдет из баллона, а температура при этом понизится на 8°C?
Краткие итоги главы III
Между термодинамическими параметрами существует связь, даваемая уравнением состояния. Все достаточно разреженные газы (идеальные газы) подчиняются уравнению состояния Менделеева-Клапейрона: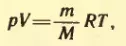
где p – давление, V – объем, m – масса газа, M – молярная масса, T – абсолютная температура, R = 8,31 Дж/(К*моль) – универсальная газовая постоянная.
Уравнение состояния содержит в себе в качестве частных случаев газовые законы, связывающие изменение двух термодинамических параметров при неизменном значении третьего:
для данной массы газа при T = const pV = const (закон Бойля-Мариотта);
при p = const V = V0αT (закон Гей-Люссака), где V0 – объем при 0°C, α – температурный коэффициент объемного расширения, 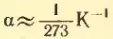 ;
;
при V = const p = p0γT (закон Шарля), где p0 – давление при 0°C, а γ = 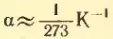 температурный коэффициент давления.
температурный коэффициент давления.
