Переход электрона между уровнями энергии в атоме — это процесс изменения энергетического состояния электрона с одного орбитального уровня на другой. Когда электрон атома водорода переходит с более высокого уровня (ближе к ядру, с высоким n) на более низкий (дальше от ядра, с низким n), он излучает фотон.
Фотон, испускаемый при переходе, имеет определённую длину волны, которая соответствует разности энергий между двумя уровнями. Этот процесс играет ключевую роль в атомной физике и спектроскопии, позволяя исследовать структуру атомных уровней и характеризовать свойства атомов и молекул.
- 🧪 Как работает атом водорода и его энергетические уровни?
- 📏 Что такое длина волны фотона и как её измерить?
- 📚 Формула для расчёта длины волны при переходе электрона
- 📝 Пример расчёта длины волны для перехода с n=5 на n=3
- 🔎 Какие факторы могут повлиять на точность расчётов?
- 🌐 Применение полученных знаний в научных и практических задачах
- 📸 Видео
Видео:Энергетические уровни атома (видео 6) | Квантовая физика | ФизикаСкачать

 🧪 Как работает атом водорода и его энергетические уровни?
🧪 Как работает атом водорода и его энергетические уровни?
Атом водорода состоит из одного протона в ядре и одного электрона, движущегося вокруг ядра. Простая структура позволяет легко изучать его поведение и энергетические состояния. Электрон в атоме водорода может находиться на разных орбитах, соответствующих определённым уровням энергии.
Энергетические уровни представляют собой дискретные значения энергии, на которых может находиться электрон. Эти уровни обозначаются квантовым числом n. Чем больше значение n, тем дальше орбита электрона от ядра и выше его энергия. Например, n=1 — это основное состояние, а n=2, n=3 и так далее — это возбуждённые состояния.
Переход электрона между уровнями сопровождается поглощением или испусканием энергии в виде фотона. Когда электрон переходит с более высокого уровня на более низкий, излучается фотон, энергия которого равна разнице энергий между уровнями. Напротив, поглощение фотона происходит, если электрон поднимается на более высокий энергетический уровень.
Энергетические уровни атома водорода можно рассчитать с помощью формулы Бора. Эта формула учитывает заряд ядра, массу электрона и планковскую постоянную. Для водорода она выглядит так: En = -13.6 eV / n2, где En — энергия уровня, а n — квантовое число.
Энергетические уровни играют ключевую роль в спектральных линиях атома водорода. При переходах между уровнями атом испускает или поглощает свет на конкретных длинах волн, создавая спектр. Этот спектр используется для идентификации вещества в астрономии и других науках.
В итоге, понимание работы энергетических уровней водорода помогает объяснить многие явления в физике и химии, такие как спектральный анализ и квантовая механика.
Видео:Спектр излучения водорода (видео 12) | Квантовая физика | ФизикаСкачать
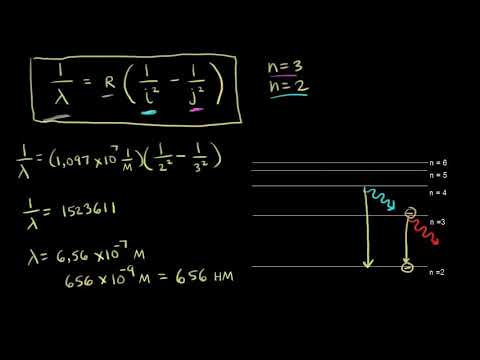
 📏 Что такое длина волны фотона и как её измерить?
📏 Что такое длина волны фотона и как её измерить?
Длина волны фотона определяется как расстояние между двумя соседними точками на волне, которое повторяется в течение одного периода колебаний. В контексте электронных переходов в атоме водорода, длина волны фотона соответствует энергетическому уровню, на котором происходит переход электрона.
Измерение длины волны фотона производится с помощью спектрального анализа, где используется специализированный инструмент, называемый спектрографом. Этот прибор разделяет свет на составляющие его цвета, открывая возможность измерить длину волны каждой из спектральных линий, которые характеризуют переходы между энергетическими уровнями атома водорода.
Видео:Урок 445. Особенности спектра атома водорода. Диаграмма ГротрианаСкачать
 📚 Формула для расчёта длины волны при переходе электрона
📚 Формула для расчёта длины волны при переходе электрона
Для определения длины волны (λ) фотона, испускаемого атомом водорода при переходе электрона с одного энергетического уровня на другой, используется формула, основанная на законах квантовой механики. Эта формула связывает длину волны с разностью энергий между начальным (n₁) и конечным (n₂) энергетическими уровнями:
λ = R * (1/𝑛₁² — 1/𝑛₂²)
Где:
- λ — длина волны фотона, выраженная в метрах (м).
- R — постоянная Ридберга для водорода, которая составляет приблизительно 1.097 * 10⁷ м⁻¹.
- 𝑛₁, 𝑛₂ — целые числа, представляющие энергетические уровни атома водорода (𝑛₁ > 𝑛₂ и оба больше нуля).
Эта формула позволяет точно рассчитать длину волны для любого перехода электрона в атоме водорода, где известны начальный и конечный уровни энергии.
Видео:СТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

📝 Пример расчёта длины волны для перехода с n=5 на n=3
Для расчёта длины волны фотона, испускаемого атомом водорода при переходе электрона с энергетического уровня n=5 на уровень n=3, используется формула:
λ = hc / ΔE
Где:
- λ — длина волны фотона,
- h — постоянная Планка (6.626 × 10-34 Дж·с),
- c — скорость света в вакууме (3.00 × 108 м/с),
- ΔE — разность энергий между начальным (n=5) и конечным (n=3) уровнями атома водорода.
Шаги расчёта:
- Найдите разность энергий между уровнями: ΔE = E5 — E3, где En = -13.6eV / n2 (энергия электрона на n-ом уровне).
- Подставьте значения h, c и ΔE в формулу для λ.
- Рассчитайте λ и получите результат в нанометрах (нм).
Пример:
Если ΔE = 13.6eV * (1/9 — 1/25), то после подстановки получается λ = 656 нм
Видео:Волна де Бройля (видео 4) | Квантовая физика | ФизикаСкачать
🔎 Какие факторы могут повлиять на точность расчётов?
Точность расчётов длины волны фотона, испускаемого атомом водорода при переходе электрона с n=5 на n=3, может зависеть от нескольких ключевых факторов:
- Качество и точность измерения начального и конечного энергетических уровней электрона в атоме водорода.
- Точность значений констант, используемых в формуле для расчёта длины волны фотона, таких как постоянная Ридберга и масса электрона.
- Влияние окружающей среды на параметры атома водорода, что может изменить его энергетические уровни.
- Погрешности в измерительных приборах, которые могут влиять на точность определения частоты или длины волны излучения.
- Эффекты внешних полей или радиации, которые могут вызывать сдвиги в энергетических уровнях атома водорода.
Видео:БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать

🌐 Применение полученных знаний в научных и практических задачах
Изучение длины волны фотона, испускаемого атомом водорода при переходе электрона между энергетическими уровнями n=5 и n=3, имеет широкие научные и практические применения. Научные лаборатории и институты используют эти данные для разработки точных методов спектрального анализа. Это необходимо для исследования состава звёзд, галактик и космических объектов.
Практически эти знания применяются в различных технологиях, таких как спектроскопия для анализа химических элементов в материалах, медицинская диагностика на основе спектральных данных и создание точных измерительных приборов, например, лазеров и оптических систем.
📸 Видео
Квантовая физика Энергетические уровни в атома (перезалив)Скачать

Квантовые постулаты Бора. Модель атома | Физика 11 класс #43 | ИнфоурокСкачать

Урок 459. Обзор квантовой теории атома водородаСкачать

ХИМИЯ ПРОСТО — Электронная конфигурация атомаСкачать

Дифракция и интерференция | Волновая оптика | ЕГЭ 2023 по физике | Снежа Планк из ВебиумаСкачать

Квантовая физика. Энергетические уровни атома водородаСкачать

ПОСТУЛАТЫ БОРА. Атомная физика. Подготовка к ЕГЭ по физике. ТехноскулСкачать

Ядерная физика от А до Я. В - Волны де БройляСкачать

Урок 447. Модель атома водорода по БоруСкачать

Урок 444. Постулаты Бора. Опыты Франка и ГерцаСкачать

Урок 2. Постулаты Бора. Модель атома водорода по Бору. Теория. ЕГЭСкачать

Физика 11 класс (Урок№25 - Квантовые постулаты Бора.)Скачать

Модель атома РезерфордаСкачать

Волновые свойства частиц. Волны де Бройля. 11 класс.Скачать


 🧪 Как работает атом водорода и его энергетические уровни?
🧪 Как работает атом водорода и его энергетические уровни? 📏 Что такое длина волны фотона и как её измерить?
📏 Что такое длина волны фотона и как её измерить? 📚 Формула для расчёта длины волны при переходе электрона
📚 Формула для расчёта длины волны при переходе электрона




