Возникновение света
Очарование света
Свет уже много тысячелетий привлекает человека. И солнечные лучи, и костер обладают особой притягательной силой. После изобретения лампы накаливания свет для большинства людей стал чем-то совсем привычным.

Свет существует всегда, днем и ночью, и благодаря ему мы видим окружающие предметы. А возможно все это лишь потому, что электроны располагаются на уровнях с различными значениями энергии. Какие процессы при этом происходят — в принципе понять совсем нетрудно.
Электронные уровни и энергия
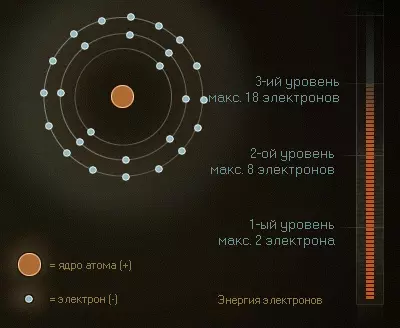
Как мы видели, электроны в оболочке располагаются по так называемым уровням. На каждом уровне может разместиться ограниченное число электронов: на самом близком к ядру — всего два, на следующем уже восемь, а на третьем целых 18. На внутренних уровнях электроны обладают меньшей энергией, а на внешних — большей. Таким образом, энергия электрона увеличивается по мере возрастания номера уровня и удаления от ядра.
Естественно, в первую очередь электроны занимают уровни с минимальной энергией. Это легко объяснить: отрицательно заряженные электроны притягиваются положительно заряженным ядром и поэтому приближаются к нему, насколько возможно. Такое состояние электронов называют основным (невозбужденным).


Это стремление к основному состоянию можно сравнить с поведением шарика, находящегося в полусфере. Если поднять его из нижней точки полусферы к краю, то он будет стремиться обратно к нижней точке и через некоторое время остановится там.
В качестве другого примера можно привести растянутую пружину. Если ее отпустить, она снова сожмется, тем самым вернувшись в основное энергетическое состояние. Оба случая иллюстрируют основополагающий принцип природы, и примеров можно найти сколько угодно.
Возбужденные электроны
Если подвести энергию извне, электрон "помимо своей воли" переходит на более высокий уровень, в возбужденное состояние. Однако возбужденный электрон чрезвычайно упрям и остается в таком состоянии совсем недолго, 10-8 секунды, то есть одну сотую миллисекунды. Затем он возвращается в основное состояние, выделяя при этом энергию в форме частицы света, называемой фотоном. Энергия фотона в точности равна разности энергий возбужденного и основного состояния.
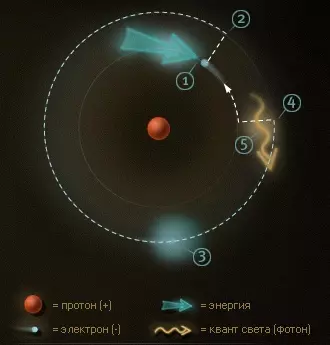
- Электрон в основном состоянии получает дополнительную энергию.
- Электрон в возбужденном состоянии на втором уровне.
- Электрон остается в возбужденном состоянии порядка 10-8 секунды.
- Электрон возвращается на первый уровень, в основное состояние.
- При этом энергия возбужденного состояния снова высвобождается (испускается) в форме кванта света.
Возбудить электроны можно разными способами, например, высокой температурой. Образно говоря, при высоких температурах атомы начинают дрожать особенно сильно. Из-за этого дрожания электроны в электронной оболочке переходят на более высокий энергетический уровень. Это называют термическим возбуждением.
Свет, излучаемый раскаленными телами (нитью лампы накаливания, Солнцем), порождают "перескакивающие" обратно электроны. Если бы электроны не были такими упрямыми и не стремились обратно в основное состояние, то не существовало бы ни света, ни Солнца, ни тех, кто это заметил бы.
Возбуждение электронов может проходить и под влиянием квантов света. Это называют оптическим возбуждением. Однако квант света должен обладать энергией, в точности равной разности между двумя состояниями электрона, ни больше, ни меньше.
Видимый спектр
Кванты света, обладающие различной энергией, мы воспринимаем как разные цвета. Белый свет Солнца содержит все цвета, которые мы видим в радуге. С помощью призмы солнечный свет можно разложить в так называемый непрерывный спектр. Цвета спектра называют также спектральными. Кванты синего цвета отличаются большей энергией и меньшей длиной волны, тогда как у фотонов красного цвета энергия ниже, а длина волны больше.
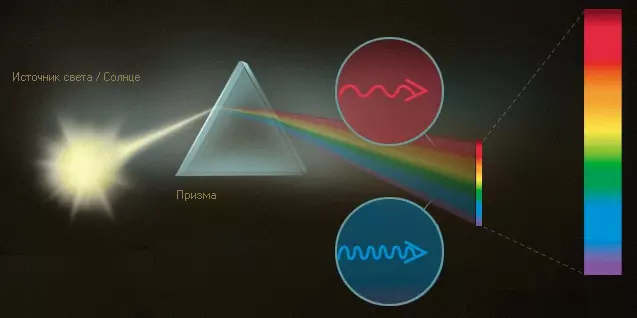
Спектры поглощения
Поскольку для возбуждения электрона в атоме водорода требуется вполне конкретная энергия, разумеется, подойдут лишь строго определенные кванты света из непрерывного спектра. Поясним это несложным экспериментом:
Если пропустить непрерывный спектр сквозь наполненный водородом стеклянный сосуд, некоторые части спектра станут почти не видны. В спектре появятся темные полосы. Определенные световые кванты спектра поглощаются атомами водорода и исчезают. Поэтому темные полосы называются также линиями поглощения.

Спектры испускания
При поглощении фотонов электроны переходят в возбужденное состояние. Когда они возвращаются в основное состояние, возникают новые фотоны, имеющие ту же длину волны и, следовательно, тот же цвет, что и поглощенные, однако излучаются они в произвольных направлениях. Лишь очень немногие кванты, соответствующие этому цвету, попадают на проекционную поверхность, поэтому и возникают темные полосы.
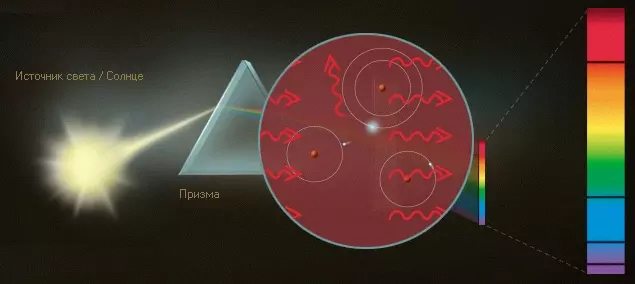

Но если теперь собрать свет, излучаемый во все стороны, и пропустить его через призму, возникнет линейчатый спектр, полностью дополнительный к темным полосам. Поскольку этот свет излучается, иными словами, испускается атомами водорода, такой линейчатый спектр называют также спектром испускания.
"Отпечатки пальцев" далеких солнц
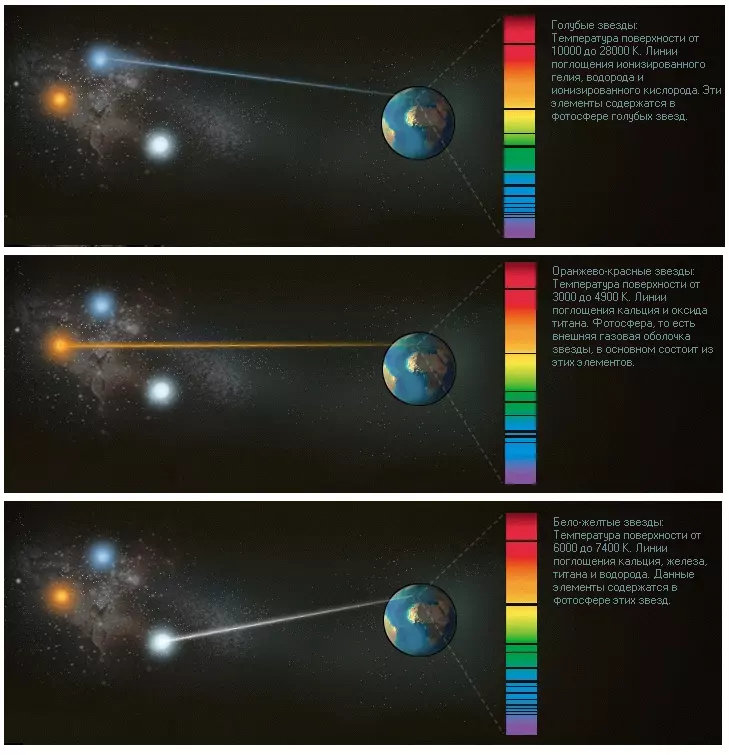
Свет, доходящий до нашей Земли от звезд далеких галактик, также можно разложить в спектр. При этом мы выясним, из каких элементов состоят звезды, поскольку каждый элемент при возбуждении дает неповторимый спектр, словно отпечатки пальцев.
Поскольку на Земле мы можем получить спектр любого элемента, путем простого сравнения можно изучать состав небесных тел, удаленных от нас на колоссальные расстояния.