В мире газов фундаментальными величинами являются давление, объем и температура. Для понимания поведения газовых веществ важно разобраться в определениях каждого из этих понятий.
Давление — это сила, которую газовые молекулы оказывают на стенки сосуда, в котором находится газ, и измеряется в атмосферах или паскалях. Чем больше молекул и чем быстрее они двигаются, тем выше давление.
Объем газа — это пространство, которое он занимает в сосуде. Он может изменяться в зависимости от изменений давления и температуры.
Температура влияет на движение молекул газа: чем выше температура, тем быстрее они двигаются, что приводит к увеличению давления.
Понимание этих основных понятий позволяет применять закон Бойля-Мариотта для предсказания изменений состояния газа при различных условиях.
- 🔍 Закон Бойля-Мариотта: что нужно знать
- 📏 Как изменяется давление при уменьшении объема
- 🔢 Пример расчета давления после изменения объема
- 📝 Пошаговая инструкция по применению закона Бойля-Мариотта
- 🛠 Инструменты и материалы для эксперимента с газом
- ⚠️ Частые ошибки при расчете изменения давления
- 🔬 Применение закона Бойля-Мариотта в реальной жизни
- 📚 Дополнительные ресурсы для углубления знаний о газах
- 🌟 Видео
Видео:Атмосферное давлениеСкачать

 🔍 Закон Бойля-Мариотта: что нужно знать
🔍 Закон Бойля-Мариотта: что нужно знать
Закон Бойля-Мариотта описывает зависимость между давлением и объемом газа при постоянной температуре. Согласно этому закону, если объем газа изменяется при постоянной температуре, его давление прямо пропорционально изменению объема: при увеличении объема давление уменьшается, и наоборот.
Джон Бойль и Эд Роберт Мариотт установили этот закон в XVII веке, основываясь на экспериментальных данных. Он является одним из основных принципов в физике газов и широко применяется в научных и инженерных расчетах.
Важно отметить, что закон Бойля-Мариотта действует только при постоянной температуре. Если температура изменяется, применяется комбинированный закон Гей-Люссака.
Видео:Давление газаСкачать
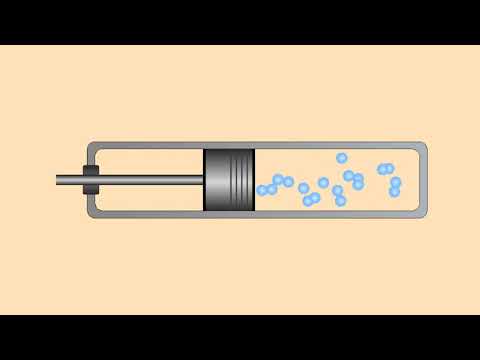
 📏 Как изменяется давление при уменьшении объема
📏 Как изменяется давление при уменьшении объема
Когда объем газа сокращается при постоянной температуре, давление газа возрастает пропорционально. Это явление описывается законом Бойля-Мариотта, согласно которому при уменьшении объема газа при неизменной температуре, давление газа увеличивается в соответствии с обратной пропорциональностью объему.
Иначе говоря, если объем газа уменьшается в два раза, то давление газа увеличивается в два раза. Это явление обусловлено тем, что при уменьшении объема газа частицы газа начинают сталкиваться с внутренними стенками сосуда чаще, что приводит к увеличению силы их ударов и, как следствие, к повышению давления.
Таким образом, изменение объема газа является одним из ключевых факторов, влияющих на изменение давления в закрытом сосуде при постоянной температуре.
Видео:Связь между давлением, объёмом и температурой газаСкачать

🔢 Пример расчета давления после изменения объема
Допустим, изначально в сосуде находится газ при давлении 2 атмосферы и объеме V1. Согласно закону Бойля-Мариотта, при уменьшении объема в два раза при постоянной температуре, давление газа увеличится в два раза.
Исходные данные:
- Начальное давление (P1) = 2 атмосферы
- Начальный объем (V1)
- Конечный объем (V2) = V1 / 2
Для расчета конечного давления (P2) используем формулу:
- Начальное давление (P1) * Начальный объем (V1) = Конечное давление (P2) * Конечный объем (V2)
Тогда:
P2 = P1 * (V1 / V2)
Заменяя известные значения:
P2 = 2 * (V1 / (V1 / 2))
Упрощаем выражение:
P2 = 2 * 2
Следовательно, после уменьшения объема в два раза, давление газа увеличится и составит 4 атмосферы.
Видео:Два вопроса про атмосферное давлениеСкачать

📝 Пошаговая инструкция по применению закона Бойля-Мариотта
Для применения закона Бойля-Мариотта в эксперименте с газами следуйте этим шагам:
- Выберите газ и измерьте начальные параметры: Определите начальное давление (P1), объем (V1) и температуру (T1) газа в сосуде.
- Измените объем газа: Уменьшите или увеличьте объем газа в сосуде, сохраняя температуру постоянной. Обозначим новый объем как V2.
- Запишите новые данные: Зафиксируйте новые параметры газа после изменения объема: P2 (новое давление) и V2 (новый объем).
- Примените закон Бойля-Мариотта: Используйте формулу P1 * V1 = P2 * V2, чтобы рассчитать давление газа после изменения объема.
- Проверьте результат: Убедитесь, что расчеты корректны и соответствуют ожидаемым значениям. При необходимости повторите эксперимент для точности.
Видео:Связь между давлением и объёмом газаСкачать

🛠 Инструменты и материалы для эксперимента с газом
Для проведения эксперимента с газом в условиях, когда его объем уменьшается при постоянной температуре, вам понадобятся следующие инструменты и материалы:
- Герметичный сосуд, способный выдерживать изменения давления внутри
- Манометр для измерения давления газа в сосуде
- Различные объемные меры для измерения начального и конечного объема газа
- Для работы с законом Бойля-Мариотта важно иметь точные измерительные инструменты
Выбирая инструменты, обратите внимание на их точность и герметичность, так как от этого зависит корректность эксперимента и получение достоверных результатов.
Видео:Физика 7 класс (Урок№19 - Природа давления газов и жидкостей. Закон Паскаля.)Скачать

⚠️ Частые ошибки при расчете изменения давления
Ошибки при расчете изменения давления при применении закона Бойля-Мариотта могут возникать из-за неправильного понимания основных концепций.
Первая распространенная ошибка — неправильное определение начального и конечного состояний газа. Важно точно определить давление и объем газа до и после изменения, чтобы правильно применить закон.
Вторая ошибка — игнорирование влияния температуры. Закон Бойля-Мариотта действует при постоянной температуре, поэтому необходимо убедиться, что температура остается неизменной в процессе эксперимента.
Третья распространенная ошибка — неправильное использование формулы закона Бойля-Мариотта. Некоторые исследователи могут ошибочно применять формулы для других законов, что приводит к неверным результатам.
Видео:Давление газа | Физика 7 класс #27 | ИнфоурокСкачать

🔬 Применение закона Бойля-Мариотта в реальной жизни
Закон Бойля-Мариотта описывает, как изменяется давление и объем газа при изменении объема при постоянной температуре. Этот закон имеет широкое применение в различных аспектах повседневной жизни.
Одним из примеров использования закона является принцип работы автомобильных тормозных систем. Воздух, сжимаемый в тормозных цилиндрах, изменяет свое давление при сжатии или расширении, в соответствии с законом Бойля-Мариотта. Это обеспечивает эффективность и надежность торможения.
Еще одним примером может служить использование закона в процессах хранения и транспортировки сжиженных или сжатых газов. При изменении объема контейнера или цистерны, где хранится газ, давление внутри изменяется согласно закону, что критически важно для безопасности и эффективности использования.
В медицинской технике закон применяется при разработке и эксплуатации медицинских газовых аппаратов и средств доставки газовых смесей. Регулирование давления и объема газов позволяет точно дозировать лекарственные средства и обеспечивать комфортные условия для пациентов.
Таким образом, понимание и применение закона Бойля-Мариотта играет ключевую роль в множестве технологий и промышленных процессов, обеспечивая их эффективность, безопасность и надежность в повседневной жизни.
Видео:В закрытом сосуде находится 6 г водяного пара под давлением 25 кПа и при температуре 100 °C. Не - №Скачать

📚 Дополнительные ресурсы для углубления знаний о газах
Погружение в мир газов может потребовать дополнительной информации. Вот несколько полезных ресурсов для тех, кто стремится глубже понять физические свойства газов и их поведение:
- Книга «Основы физики газов»: Издание, которое подробно освещает основные законы и теории, связанные с поведением газов в различных условиях.
- Курс «Химия газов»: Онлайн-курс, предоставляющий обзорные лекции и практические задания для изучения химических свойств газов.
- Научные журналы и публикации: Посещение сайтов научных издательств и доступ к актуальным исследованиям о физике газов и их применениях.
- Образовательные видео на YouTube: Каналы, посвященные физике и химии, предлагают видеоуроки о законах газов и их практическом применении.
Эти ресурсы помогут углубить ваши знания о газах и их характеристиках, дополняя базовые концепции, рассмотренные в данной статье.
🌟 Видео
Атмосферное давление. Измерение атмосферного давления. 7 класс.Скачать

В закрытом сосуде при температуре 100 °С находится влажный воздух с относительной влажностью 70 - №Скачать

Физика 7 Давление газаСкачать

Давление в жидкости и газе | Физика 7 класс #29 | ИнфоурокСкачать

Давление в жидкостях и газах. Закон Паскаля. 7 класс.Скачать

Передача давления жидкостями и газам. Закон Паскаля | Физика 7 класс #28 | ИнфоурокСкачать

География 7 класс. Распределение атмосферного давления и осадков на ЗемлеСкачать

Физика 7 класс. § 37 Давление газаСкачать

Физика 7 класс Давление газа Закон ПаскаляСкачать

Давление газаСкачать

37 Давление газа и жидкостей. Решение задачСкачать

§ 37. Давление газа.Скачать


 🔍 Закон Бойля-Мариотта: что нужно знать
🔍 Закон Бойля-Мариотта: что нужно знать 📏 Как изменяется давление при уменьшении объема
📏 Как изменяется давление при уменьшении объема




