Применение уравнения состояния идеального газа к различным процессам
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса и один из трех параметров – p, V или T – остаются неизменными. Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами.
Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами. (От греческого слова «изос» – равный.) Изопроцессы широко распространены в природе и часто используются в технике.
Изотермический процесс. Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим. Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплотой с большой системой – термостатом. Термостатом может служить атмосферный воздух, если температура его заметно не меняется на протяжении процесса.
Согласно уравнению состояния идеального газа (3.4) в любом состоянии с неизменной температурой произведение давления газа на объем одно и то же: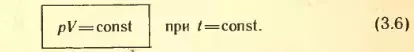
Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется.
Этот закон был открыт экспериментально английским ученым Бойлем и несколько позднее французским ученым Мариоттом. Поэтому он носит название закона Бойля-Мариотта.
Закон Бойля-Мариотта справедлив для любых газов, а также для смеси газов (например, для воздуха). Лишь при давлениях, в несколько тысяч раз больших атмосферного, отклонения от этого закона становятся существенными.
Убедиться в справедливости закона Бойля-Мариотта при давлениях, близких к атмосферному, можно с помощью установки, описанной в предыдущем параграфе.
Зависимость давления газа от объема при постоянной температуре изображается графически кривой, которая носит название изотермы (рис 32). Изотерма газа изображает обратно пропорциональную зависимость между давлением и объемом. Кривую такого рода в математике называют гиперболой. Разным постоянным температурам соответствуют различные изотермы. При повышении температуры давление согласно уравнению состояния (3.4) увеличивается, если V – const. Поэтому изотерма, соответствующая более высокой температуре T2 лежит выше изотермы, соответствующей белее низкой температуре T1.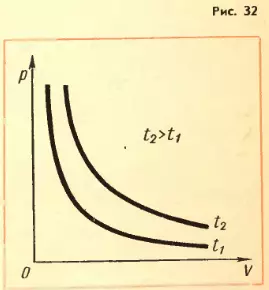
Изобарный процесс. Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным. (От греческого слова «барос» – тяжесть, вес.)
Из уравнения состояния идеального газа (3.4) вытекает, что отношение объемов газа данной массы при постоянном давлении равно отношению его абсолютных температур. Действительно, для первого состояния: 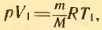 , для второго состояния:
, для второго состояния: 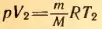 (давление постоянно). Отсюда, разделив первое уравнение на второе, получим:
(давление постоянно). Отсюда, разделив первое уравнение на второе, получим:
Если в качестве второго состояния газа выбрать состояние при нормальных условиях (p0 – нормальное атмосферное давление, T0 = 273 К – температура таяния льда, V0 – объем при этих условиях), V1 и T1 обозначить через V и T, то из (3.7) следует: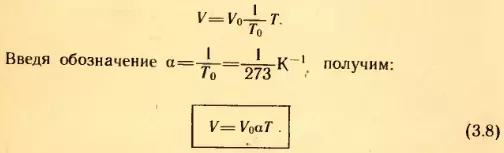
Этот газовый закон был установлен экспериментально в 1802 г. французским ученым Гей-Люссаком и носит название закона Гей-Люссака: объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре.
Коэффициент α называют температурным коэффициентом объемного расширения газов. Все газы увеличивают свой объем на 1/273 часть того объема, который каждый из газов занимал при 273 К (0°C), если температура меняется на 1 К.
Зависимость объема газа от температуры при постоянном давлении изображается графически прямой, которая называется изобарой (рис. 33).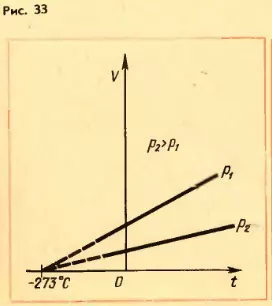
Различным давлениям соответствуют разные изобары. С ростом давления объем газа при постоянной температуре согласно закону Бойля-Мариотта уменьшается. Поэтому изобара, соответствующая более высокому давлению p2, лежит ниже изобары, соответствующей более низкому давлению p1.
В области низких температур все изобары идеального газа пересекаются в точке T=0. Но это не означает, что объем реального газа действительно обращается в нуль. Все газы при сильном охлаждении превращаются в жидкости, а к жидкостям уравнение состояния (3.4) не применимо.
Изохорный процесс. Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. (От греческого слова «хорема» – вместимость.)
Из уравнения состояния (3.4) вытекает, что отношение давлений газа данной массы при постоянном объеме равно отношению его абсолютных температур:
Если в качестве одного из состояний газа выбрать состояние газа при нормальных условиях, а p1 и T1 обозначить через p и T, то из (3.9) следует: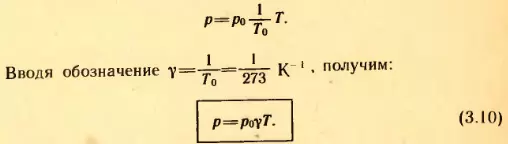
Этот газовый закон был установлен экспериментально в 1787 г. французским физиком Ж. Шарлем и носит название закона Шарля: давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре.
Коэффициент γ (равный температурному коэффициенту объемного расширения α) называют температурным коэффициентом давления газа. Он одинаков для всех газов. Все газы увеличивают свое давление на 1/273 того давления, которое каждый из газов имел при 273 К (0°C), если температура возрастает на 1 К.
Зависимость давления газа от температуры при постоянном объеме изображается графически прямой, которая называется изохорой (рис. 34). Разным объемам соответствуют разные изохоры. С ростом объема газа при постоянной температуре давление его согласно закону Бойля-Мариотта падает. Поэтому изохора, соответствующая большему объему V2, лежит ниже изохоры, соответствующей объему V1.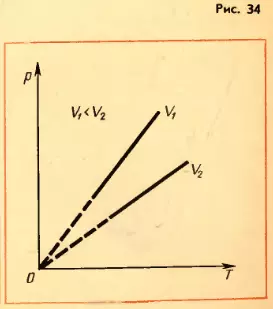
В соответствии с уравнением (3.10) все изохоры начинаются в точке T = 0. Значит, давление идеального газа при абсолютном нуле равно нулю.
