Основные положения молекулярно-кинетической теории. Размеры молекул
В основе молекулярно-кинетической теории строения вещества лежат три положения, каждое из которых доказано с помощью опытов: вещество состоит из частиц; эти частицы хаотически движутся; частицы взаимодействуют друг с другом.
Свойства и поведение тел, начиная от разреженных газов верхних слоев атмосферы и кончая твердыми телами на Земле, а также сверхплотными ядрами планет и звезд, определяются движением взаимодействующих друг с другом частиц, из которых состоят все тела, – молекул, атомов или еще более малых образований – элементарных частиц. (Напомним: атом – наименьшая частица химического элемента, носитель его свойств; молекула – наименьшая устойчивая частица вещества, обладающая его химическими свойствами; молекулы образуются из атомов.)
Оценка размеров молекул. Для полной уверенности в реальности существования молекул необходимо определить их размеры.
Рассмотрим сравнительно простой метод оценки размеров молекул. Известно, что нельзя заставить капельку оливкового масла объемом 1 мм³ расплыться на поверхности воды так, чтобы она заняла площадь более 0,6 м². Можно предположить, что при растекании масла по максимальной площади оно образует слой толщиной всего лишь в одну молекулу. Толщину этого слоя нетрудно определить и тем самым оценить размеры молекулы оливкового масла.
Разрежем мысленно кубик объемом 1 мм³ на квадратные слои по 1 мм² площади так, чтобы ими можно было покрыть площадь 0,6 м² (рис. 2). Число таких слоев будет равно:  . Толщину слоя масла, а следовательно, и размер молекулы оливкового масла можно найти, разделив ребро куба в 0,1 см на число слоев:
. Толщину слоя масла, а следовательно, и размер молекулы оливкового масла можно найти, разделив ребро куба в 0,1 см на число слоев: 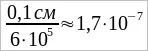 см.
см.
Ионный проектор. В настоящее время перечислять всевозможные способы доказательства существования атомов и молекул нет необходимости. Современные приборы позволяют наблюдать изображения отдельных атомов и молекул. В учебнике физики для VI класса приведена фотография, полученная с помощью электронного микроскопа, на которой можно видеть расположение отдельных атомов на поверхности кристалла золота.
Но электронный микроскоп – очень сложное устройство. Мы познакомимся с гораздо более простым прибором, позволяющим получать изображения отдельных атомов и оценивать их размеры. Этот прибор называется ионным проектором или ионным микроскопом. Устроен он следующим образом: в центре сферического сосуда радиусом около 10 см расположено острие вольфрамовой иглы (рис. 3). Радиус кривизны острия делают настолько малым, насколько это возможно при современной технике обработки металлов, – около 5 · 10–6 см. Внутреннюю поверхность сферы покрывают тонким проводящим слоем, способным, подобно экрану телевизионной трубки, светиться под действием ударов быстрых частиц. Между положительно заряженным острием и отрицательно заряженным проводящим слоем создают напряжение в несколько сотен вольт. Сосуд заполняют гелием при малом давлении 100 Па (0,75 мм рт. ст.).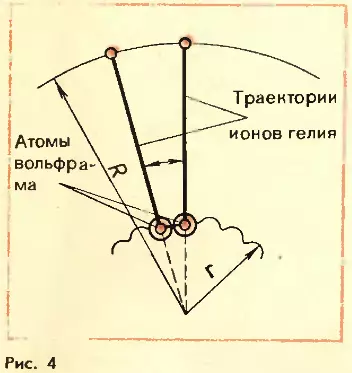
Атомы вольфрама на поверхности острия образуют микроскопические «бугорки» (рис. 4). При сближении хаотически движущихся атомов гелия с атомами вольфрама электрическое поле, особенно сильное вблизи атомов на поверхности острия, отрывает электроны у атомов гелия и превращает эти атомы в ионы. Ионы гелия отталкиваются от положительно заряженного острия и с большой скоростью движутся вдоль радиусов сферы. Сталкиваясь с поверхностью сферы, ионы вызывают ее свечение. В результате на экране возникает увеличенная картина расположения атомов вольфрама на острие (рис. 5). Светлые пятнышки на экране – это изображения отдельных атомов.
Увеличение проектора – отношение расстояния между изображениями атомов к расстоянию между самими атомами – оказывается равным отношению радиуса сосуда к радиусу острия и достигает двух миллионов. Именно поэтому удается видеть отдельные атомы.
Диаметр атома вольфрама, определяемый с помощью ионного проектора, оказывается равным приблизительно 2 · 10–8 см. Размеры атомов, найденные другими методами, оказываются примерно такими же. Размеры молекул, состоящих из многих атомов, естественно, больше.
Но все же эти размеры так малы, что их невозможно себе представить. Что вам может сказать, например, число 2,3 · 10–8 см – размер молекулы водорода? В таких случаях прибегают к помощи сравнения. Вот одно из них. Если ручку, которой вы пишите, увеличить так, чтобы она доставала от Земли до Луны, то молекула водорода при том же увеличении примет размеры ручки.
Число молекул. При очень малых размерах молекул число их в любом макроскопическом теле огромно. Подсчитаем приближенно число молекул в капле воды массой 1 г и, следовательно, объемом 1 см³. Диаметр молекулы воды равен примерно 3 · 10–8 см. Считая, что каждая молекула воды при плотной упаковке молекул занимает объем (3 · 10–8 см)³, можно найти число молекул в капле, разделив объем капли (1 см³) на объем, приходящийся на одну молекулу:
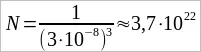 .
.
При каждом вдохе вы захватываете в легкие столько молекул, что если бы все они после выдоха равномерно распределились в атмосфере Земли, то каждый житель планеты при вдохе получил бы две молекулы, побывавшие в ваших легких.
