Уравнение состояния идеального газа
Уравнение состояния. Мы детально рассмотрели поведение идеального газа с точки зрения молекулярно-кинетической теории. Была определена зависимость давления газа от концентрации его молекул и температуры (формула 2.10). На основе этой зависимости можно получить уравнение, связывающее все три макроскопических параметра p, V и T, характеризующие состояние данной массы достаточно разреженного газа. Это уравнение называют уравнением состояния идеального газа.
Подставим в уравнение (2.10) p = nkT выражение для концентрации газа. Учитывая формулы (1.3) и (1.7), концентрацию газа можно представить следующим образом:
где NA – постоянная Авогадро, m – масса газа, M – его молярная масса.
После подстановки (3.1) в (2.10) будем иметь:
Произведение постоянной Больцмана k и постоянной Авогадро NA называют универсальной газовой постоянной и обозначают буквой R:
R = kNA = 1,38 * 10-23 * 6,02 * 1023 Дж/(моль * К) = 8,31 Дж/(моль * К). (3.3)
Подставляя в уравнение (3.2) вместо произведения kNA универсальную газовую постоянную R, получим уравнение состояния для произвольной массы идеального газа:
Единственная величина в этом уравнении зависящая от рода газа, – это его молярная масса.
Из уравнения состояния (3.4) вытекает связь между давлением, объемом и температурой идеального газа в двух любых состояниях.
Если индексом 1 обозначить параметры, относящиеся к первому состоянию, а индексом 2 – параметры, относящиеся ко второму состоянию, то согласно уравнению (3.4) для данной массы газа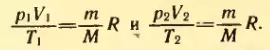
Правые части этих уравнений одинаковы. Следовательно, должны быть равны и их левые части:
Уравнение состояния в форме (3.5) носит название уравнения Клапейрона и представляет собой одну из форм записи уравнения состояния. (Клапейрон Б. П. (1799-1864) – французский физик; в течение десяти лет работал в России.)
Уравнение состояния в форме (3.4) было впервые получено великим русским ученым Д. И. Менделеевым. Поэтому его называют уравнением Менделеева-Клапейрона.

Экспериментальная проверка уравнения состояния. В справедливости уравнения состояния в форме (3.5) можно убедиться с помощью прибора, изображенного на рисунке 31.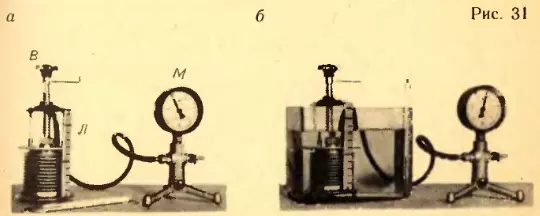
Герметический гофрированный сосуд с манометром М, регистрирующим давление внутри сосуда. При вращении винта В объем сосуда меняется. Об объеме можно судить с помощью линейки Л. Температура газа в сосуде равна температуре окружающего воздуха и регистрируется термометром.
Измеряя давление p, температуру T и объем V газа в начальном состоянии (рис. 31, а), можно вычислить отношение 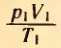 (надо помнить, что T – это абсолютная температура, а не температура по шкале Цельсия).
(надо помнить, что T – это абсолютная температура, а не температура по шкале Цельсия).
После этого нужно изменить объем сосуда нагреть газ, поместив сосуд в горячую воду (рис. 31, б). Измерив снова давление газа p2, объем V2 и температуру T2, можно вычислить отношение 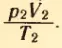 .
.
В пределах точности, обеспечиваемо экспериментальной установкой, уравнение состояния (3.5) выполняется. Лишь при давлениях в тысячи атмосфер отклонения результатов эксперимента от предсказываемых уравнением состояния идеального газа, становятся существенными. Плотные газы нельзя даже приближенно считать идеальными.
