Итоги «Основы молекулярно-кинетической теории»
Согласно основным положениям молекулярно-кинетической теории все тела состоят из молекул (или атомов); между молекулами на малых расстояниях, меньших собственных размеров молекул, действуют силы отталкивания, а на больших – силы притяжения; молекулы участвуют в хаотическом тепловом движении.
В настоящее время все основные положении молекулярно-кинетической теории строго доказаны экспериментально. Измерены массы молекул и их размеры; определен характер зависимости сил взаимодействия молекул от расстояния между ними; наблюдение хаотического движения мелких, но видимых в микроскоп твердых частиц в жидкостях и газах (броуновское движение) с несомненностью доказывает наличие теплового движения молекул.
Массы молекул малы, а число их в больших (макроскопических) телах огромно. Поэтому массы молекул и их количество в макроскопических телах выражают в относительных единицах.
Относительной молекулярной (или атомной) массой называют отношение массы молекулы (или атома) к 1/12 массы атома углерода (1.2).
Количеством вещества называют отношение числа молекул в данном теле к числу атомов в 0,012 кг углерода (1.3).
Количество вещества измеряют в молях. Моль – количество вещества, содержащее столько же молекул, сколько содержится атомов в 0,012 кг углерода.
Число молекул или атомов в моле вещества называют постоянной Авогадро 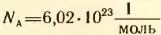 .
.
Молярной массой называют массу вещества, взятого в количестве одного моля (1.5).
В газах расстояние между молекулами много больше их размеров. В жидкостях и твердых телах молекулы (или атомы) находятся непосредственно друг возле друга. В твердых телах атомы (или молекулы) расположены в строгом порядке и совершают колебания около неизменных положений равновесия. В жидкостях молекулы расположены неупорядоченно и время от времени совершают перескоки из одного положения равновесия в другое.
В молекулярно-кинетической теории идеальным называют газ, состоящий из молекул, взаимодействие между которыми пренебрежимо мало. Средняя кинетическая энергия молекул идеального газа во много раз больше средней потенциальной энергии их взаимодействия.
Согласно основному уравнению молекулярно-кинетической теории давление газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекул: