Барометрическая формула
Движение молекул связано с тепловым состоянием тела. Чем более нагрето тело, тем оживленнее беспорядочное движение молекул. Термин «беспорядочное движение молекул» с полным правом может быть заменен термином «тепловое движение молекул».
Вследствие хаотического движения молекулы, разлетаясь во все стороны, должны бы равномерно распределиться в предоставленном им объеме. Почему же воздух, окружающий Землю, не разлетается по всему мировому пространству? Его удерживает притяжение к Земле. Это притяжение нарушает равномерное распределение молекул в мировом пространстве. С другой стороны, если бы не тепловое движение, то все молекулы упали бы на Землю. В результате борьбы этих двух тенденций — падения вниз и стремления равномерно рассеяться в окружающем пространстве — в атмосфере наблюдается некоторое распределение плотности воздуха по высоте. Молекулы сосредоточены гуще в нижних слоях и реже в верхних. Математическое выражение этой закономерности дается формулой, называемой барометрической:
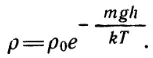
Здесь ρ – плотность воздуха на высоте h, ρ0 – плотность воздуха при h = 0, m – масса молекулы, T — абсолютная температура воздуха, k — так называемая постоянная Больцмана (k = 1,38 * 10-23 Дж/К). Описываемая барометрической формулой функция ρ есть показательная функция; ее основание выражается числом e = 2,71828... Такие показательные функции называют экспоненциальными. Заметим, что приведенная формула является упрощенной. Во-первых, как известно, воздух состоит из нескольких различных газов – азота, кислорода, водорода и др. Молекулы разных газов имеют разные массы. Чем легче газ, тем медленнее уменьшается с высотой его плотность. Во-вторых, в барометрической формуле предполагается, что температура воздуха одинакова на всех рассматриваемых высотах. Известно, однако, что температура воздуха с высотой понижается. В-третьих, надо учитывать также, что ускорение g зависит от высоты. Наконец, приведенная выше формула не учитывает ветра и конвекционных потоков воздуха, которые могут весьма заметно влиять на плотность воздуха.
Тем не менее барометрической формулой можно пользоваться как приближенной формулой, которая правильно передает основную закономерность в уменьшении плотности воздуха с высотой. Эту формулу применяют по отношению к определенному типу газа и при этом рассматривают относительно небольшие высоты.
Подчеркнем, что описываемое барометрической формулой распределение плотности по высоте оказывается неизменным, сколько бы времени мы ни наблюдали (ветер не принимается во внимание). Молекулы воздуха находятся все время в движении, сталкиваются, перемещаются из одних точек пространства в другие; тем не менее в среднем их число в единице объема на данной высоте остается неизменным.
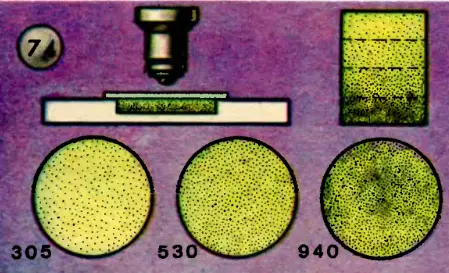
Рассмотренный закон распределения оказывается применимым не только к нижним слоям атмосферы Земли, но и к растворам, содержащим множество мелких частичек во взвешенном состоянии. Французский физик Перрен, изучавший броуновское движение, производил опыты с эмульсией спиртового раствора смолы гуммигута или мастики в воде. Предварительно жидкость подвергалась многократному центрифугированию для получения эмульсии, состоящей из очень мелких зернышек одинакового размера. Капля эмульсии помещалась в стеклянную кюветку и рассматривалась в микроскоп через маленькую диафрагму. Тогда в поле зрения можно было пересчитать видимые частицы. Изменяя высоту подвижной части микроскопа, можно получать четкие изображения частиц в разных слоях эмульсии, расположенных на разных глубинах кюветки (рис. 74). В каждом из этих слоев и подсчитывались зерна эмульсии. Чтобы исключить случайность, брали для каждого слоя среднее значение из нескольких тысяч измерений. Применяя к этому распределению барометрическую формулу, Перрен смог определить число молекул в 1 моль любого газа.
Полученное значение очень мало отличается от значения, определенного при помощи других способов. В настоящее время число молекул в 1 моль любого газа считают равным 6,02 * 1023. Это число называют числом Авогадро. Известно, что 1 моль газа при нормальных условиях занимает объем 22,4 л. Отсюда легко определить и число молекул в 1 см3 газа при нормальных условиях:
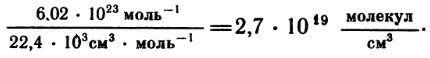
Нет, конечно, необходимости объяснять, что найденное число передает только порядок количества молекул, т. е. оно приведено так же округленно, как, скажем, число, характеризующее плотность населения какого-нибудь города.
