Кристаллы
Вы читали книги академика А. Е. Ферсмана «Занимательная минералогия», «Занимательная геохимия», «Рассказы о самоцветах» и др.? Александр Евгеньевич Ферсман широко известен не только ка выдающийся ученый-минералог и геохимик, но и как замечательный популяризатор геологических знаний.
Минералогия в представлении Ферсмана — это наука, которой могут позавидовать науки о живых существах: «На ее основе создается самая замечательная техника, получается металл, извлекается строительный камень — словом, строится все наше хозяйство и промышленность». «Я очень хочу вас увлечь, - пишет он в своей «Занимательной минералогии», - хочу, чтобы вы начали интересоваться горами и каменоломнями, рудниками и копями, что вы начали собирать коллекции минералов, чтобы вы захотели отправиться вместе с нами из города подальше, к течению реки, где высокие каменистые берега, к вершинам гор или скалистому берегу моря, туда, где ломают камень, добывают песок или взрывают руду. Там всюду мы с вами найдем, чем заняться; и в мертвых скалах, пусках и камнях мы с вами научимся читать какие-то великие законы природы, которые управляют всем миром и по которым построен весь мир».
Взгляните на кристаллы и изделия из граненых самоцветов, представленных на рисунке 95. Разве вам не хочется понять, как могла возникнуть эта красота, как образуются эти удивительные произведения природы, разве не появится желание поближе познакомиться с их свойствами? Ведь поразительно красивые кристаллы — это не только украшения; они находят разностороннее применение и в технике. Вы, конечно, слыхали об алмазном бурении, о применении рубинов в часовых механизмах и измерительных приборах, о кристаллах, применяемых в полупроводниковых приборах. А металлы — этот основной материал современной техники? Знаете ли вы, что все металлы имеют кристаллическое строение? Физик скажет вам, что всякое истинно твердое тело — кристалл. «Почти весь мир кристалличен. В мире царит кристалл и его твердые, прямолинейные законы», - писал академик Ферсман. Давайте же познакомимся поближе с основными законами кристалла.

Правильная многогранная форма прежде всего бросается в глаза наблюдателю, но не она составляет главную особенность кристаллического тела. Кристалл можно разбить на мелкие кусочки, так что не останется и следа от прежней красоты, и все-таки каждый кусочек будет по-прежнему кристаллом. Самое главное в кристалле не наружная его форма, а своеобразие его внутренних свойств. Но прежде обратим внимание на правильность формы кристалла — на симметрию. По выражению нашего знаменитого кристаллографа Е. С. Федорова, «кристаллы блещут симметрией».
Явление симметрии вам знакомо их многих примеров окружающей жизни. Симметрична бабочка (рис. 96). Форма и окраска правого крыла повторяют очертания и рисунок левого. Когда бабочка сложит крылья, эти рисунки совмещаются. Вам наверное приходилось забавляться, получая симметричные отпечатки чернильных клякс при складывании пополам листа бумаги (рис. 97). Симметричны снежинки (рис. 98). У шестиугольной снежинки вы легко обнаружите шесть плоскостей симметрии. Сгибая рисунок пол любой из линий, изображающих следы плоскости симметрии снежинки, вы совместите друг с другом две половины ее.

Ось симметрии имеет то свойство, что при повороте вокруг нее на некоторый определенный угол соответствующие части фигуры совмещаются друг с другом. Смотря по тому, на какой угол приходится повернуть при этом тело, различают у кристаллов оси 2, 3, 4, 6-го порядка. Например, у снежинок имеется одна ось 6-го порядка (перпендикулярная к плоскости чертежа). Центром симметрии называется точка внутри тела, на равном расстоянии от которой в диаметрально противоположных направлениях расположены одинаковы элементы тела.
Полезно усвоить эти понятия практически — на моделях кристаллов (рис. 99), изготовленных по прилагаемым выкройкам (рис. 100). Показанный на левом рисунке 99 кристалл при повороте на ¼ окружности вокруг оси AB совмещается сам с собой. Значит, мы имеем ось 4-го порядка. Тот же кристалл совмещается сам с собой при отражении в плоскости CDEF (как если бы это была плоскость зеркала); это есть плоскость симметрии.
Модели кристаллов можно изготовить из картона (при желании и умении обращаться со стеклом или плексигласом можно изготовить более эффектные модели из этих материалов). Чтобы, не портя книгу, перевести чертеж на картон, пользуются калькой или папиросной бумагой. Перевод с чертежа на картон нужно делать аккуратно, тщательно переведенный на картон чертеж аккуратно вырезают ножницами по периметру. По внутренним штриховым линиям делают неглубокие надрезы (на половину толщины картона). Теперь остается только согнуть выкройку по этим линиям (так, чтобы линии надреза были с наружной стороны) и склеить соприкасающиеся края модели полосками-клапанами.
Вторым шагов в изучении кристаллов будет выращивание их из растворов солей. Можно взять для этого раствор поваренной соли, раствор квасцов, раствор медного купороса. В насыщенный раствор каждой из этих солей погружают маленький кристаллик того же вещества, подвешенный на нитке. Так можно вырастить большие кристаллы.
Наши модели являются моделями монокристаллов. Плотные группы мелких, беспорядочно сросшихся кристалликов называют поликристаллами. К последней группе относятся все металлы и их сплавы.
От внешней формы кристаллов обратимся теперь к внутренней структуре их. Внутреннее строение кристаллов представляет собой соединение мельчайших частиц вещества — молекул и атомов — в определенном правильном порядке. Как же узнать о внутреннем расположении частиц, ведь они не видны не только невооруженным глазом, но даже и в лучшие микроскопы? На помощь пришли рентгеновские лучи. Просвечивая ими кристаллы, можно составить точное представление об и внутреннем строении. Работами немецкого физика М. Лауэ, английских ученых отца и сына Брэггов и московского профессора Ю. В. Вульфа установлены законы, позволяющие изучать структуру кристаллов.
И вот тут-то и начинается самое удивительное, самое неожиданное. Само представление о молекуле оказывается поколебленным, неприменимым к кристаллическому состоянию вещества. Возьмем, например, такое обычное вещество, как поваренная соль. Химики установили состав молекулы соли NaCl. Но в кристалле атомы натрия и лора не образуют отдельных молекул, а соединяются между собой в определенную конфигурацию, называемую кристаллической или пространственной решеткой (рис. 101).

Связь между атомами хлора и натрия электрическая. Можно представить себе дело так, что один из валентных электронов внешней оболочки атома натрия внедряется во внешнюю, не полностью заполненную электронами оболочку атома хлора. Ведь в атоме хлора на третьей оболочке расположено семь электронов, а для полного числа их должно быть восемь. Но в кристалле каждый ион натрия и каждый ион хлора принадлежат не одной молекуле, а всему кристаллу. Атом хлора одновалентен, т. е. может присоединить к себе только один электрон. В кристалле он окружен шестью атомами натрия, и нельзя сказать, который из них отдаст ему свой электрон. Таким образом, между химическим понятием молекулы NaCl и понятием о ней в кристалле получается расхождение. Ведь монокристалл — как бы гигантская молекула.
Следует особо предостеречь читателей от ошибки, в которую иногда впадают, рассматривая пространственную решетку как действительную модель кристалла. Решетка — это лишь условное представление соединения ионов и атомов в кристалле. Шарики в узлах решетки условно обозначают атомы, а линии, соединяющие их, так же условно изображают силы связи (см. рис. 101). В действительности расстояние между атомами кристалла значительно меньше; кристалл представляет собой плотную упаковку составляющих его частиц (рис. 102). Изображение атомов шарами условно. Шар выбран только потому, что он очень хорошо отражает свойства плотной упаковки. В действительности же происходит не просто соприкосновение, а частичное взаимное перекрывание областей отдельных атомов.

В интересной популярной книге А. И. Катайгородского «Порядок и беспорядок в мире атомов» приведено такое удачное пояснение сказанного: «Напомним, что представление об атомах как о шарах, правильно отражая одно важное свойство — свойство плотно укладываться в плотные кристаллические упаковки, вовсе не исчерпывает сложнейшей природы атомов и не означает, что атомы — просто твердые шарики. Уподобление атома шарику означает по существу следующее: вокруг атома, как центра, мы мысленно проводим сферу такого радиуса, что основная часть электронов данного атома попадает внутрь сферы. Вот и получается шар, который служит, как говорят, моделью атома».
Противоположные электрические заряды, как известно, притягиваются. Когда два иона заряжены противоположно, между ними действуют электрические силы притяжения, являющиеся связующими силами в ионных кристаллах типа поваренной соли. Но если бы мы попытались сблизить два иона так, чтобы электронные орбиты ионов начали перекрываться, то начнут действовать силы отталкивания одноименных зарядов. Правильное пространственное распределение ионов в кристалле соответствует равновесию сил притяжения и отталкивания.
Если существование сил притяжения между ионами с противоположными электрическими зарядами объясняет силы связи в ионных кристаллах, то как объяснить соединение одинаковых атомов в кристаллах, например, алмаза или графита? Оказывается, и здесь атомы соединяются с помощью электронов. У соседних атомов в этих кристаллах появляются общие, так сказать, «коллективные» электроны, которые обращаются вокруг ядер обоих атомов.
Детальная теория сил при такой связи сложна и относится к области квантовой механики.
В металлах дело обстоит еще сложнее. В этом случае простейшее, но неполное объяснение состоит в том, что металлы, как известно, легко теряют свои внешние электроны и последние, перемещаясь по всему кристаллу, образуют в нем своеобразный «электронный газ». Эти общие для всего кристалла электроны и создают силы, цементирующие решетку. Правда, объяснение это является упрощенным.
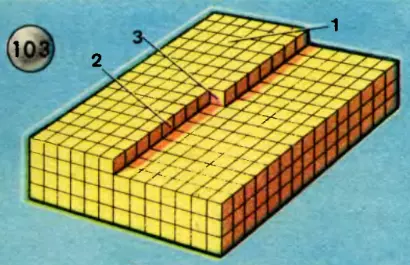
Рассмотрим теперь, как растут кристаллы. Для большей наглядности сравним рост кристалла с постепенным ростом какого-нибудь сооружения из кирпичей (рис. 103). Вот перед нами незаконченная кладка. Если рассматривать каждый кирпич как элементарную ячейку кристалла, то возникает вопрос: куда лучше положить следующий кирпич? Вот здесь-то и выступают на сцену особенности энергетики кристалла. Кирпичик, положенный сверху, на 1-й, испытывает притяжение только снизу; если же его положить рядом со 2-м, то он будет притягиваться с двух сторон; а если положить рядом с 3-м, то он будет притягиваться с трех сторон. Как известно, при переходе из жидкого состояния в твердое выделяется энергия — теплота плавления или кристаллизации. Количества энергии, выделяющейся в случаях 1, 2 и 3, относятся между собой, как 0,06:0,18:0,87. Следовательно, первый способ кладки является энергетически наименее выгодным. Из механики мы знаем, что для большей устойчивости системы ее потенциальная энергия должна быть минимальной, а в этом случае потенциальная энергия уменьшается значительно меньше, чем при укладке по третьему способу. Поэтому сначала достраивается ряд, потом вся плоскость и только потом начинается укладка новой плоскости. Кристалл растет слоями: пока один слой не достроен, следующий строиться не начинает.
Требование минимума потенциальной энергии выражается также в том, что поверхностная энергия кристалла (поверхностное натяжение в расчете на единицу площади) принимает минимальное значение. Если обломать углы кристалла, то он «залечит свои раны» и снова примет свойственную данному веществу форму. (Отметим также, что поверхностное натяжение является мерой прочности различных кристаллов: у NaCl оно равно 0,15 Н/м, у алмаза 11,4 Н/м.)
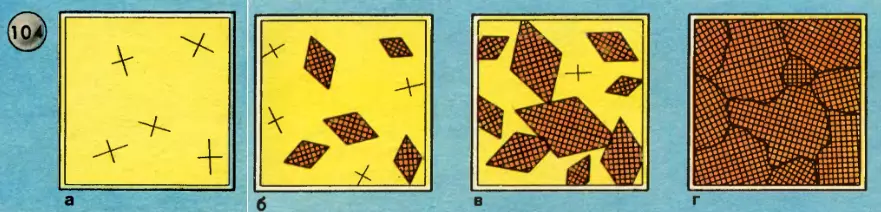
Впрочем, идеальная форма кристалла, отвечающая минимуму потенциальной энергии, представляет собой идеальный случай. В природных условиях такая форма обычно искажается (нарушается) из-за примесей и соседства других кристаллов. В металлах это особенно резко выражено и приводит к образованию мозаичной структуры поликристалла. На рисунке 104 изображены последовательные стадии роста кристалла металла из расплава. Такое же поликристаллическое строение имеют кристаллы льда в узорах, которыми мороз расписывает зимой стекла наших окон.
Обратите внимание, что ледяные иглы в этих узорах ответвляются всегда под одним и тем же углом (60°).
Закон постоянства углов между плоскостями граней — основной закон кристаллографии. Как бы ни был искажен во время роста кристалл, его двугранные углы всегда сохраняют постоянные значения для данного вида кристалла.
Особенности процесса роста кристаллов объясняются также свойством анизотропии, т. е. неодинаковостью физических свойств в различных направлениях. Монокристаллы в разных направлениях неодинаково проводят тепло, неодинаково проводят электричество, неодинаково пропускают свет, обладают неодинаковой прочностью. Если покрыть ровным слоем парафина грань кристалла горного хрусталя, а потом дотронуться нагретой спицей, то парафин расплавится в виде эллипса, а не в виде круга, как это можно наблюдать на аналогичном опыте со стеклянной пластинкой.
Один и тот же химический элемент, с одними и теми же атомами может образовывать кристаллы разных систем с разными кристаллическими решетками. Например, углерод кристаллизуется в виде алмаза (рис. 105) и в виде графита (рис. 106). Решетка графита как бы разделена на слои, которые легко сдвигаются. Когда вы пишите карандашом, то сдвинутые вами чешуйки графита ложатся в виде линии на листе бумаги. Алмаз, наоборот, представляет собой образец максимальной твердости среди минералов.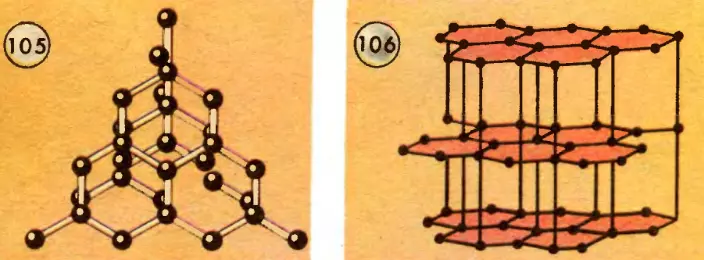
Ученые все глубже проникают в тайны строения кристаллов и находят им новые применения.
